経口セマグルチドの2型糖尿病に対する単独療法 PIONEER1 trial
ノボノルディスクファーマのGLP-1受容体作動薬セマグルチド
ノボノルディスクファーマは、セマグルチドの注射剤だけでなく経口剤も開発している。消化管経由でもバイオアベイラビリティを確保するため、経口剤にはEmisphere TechnologiesのEligenテクノロジーが使われている。
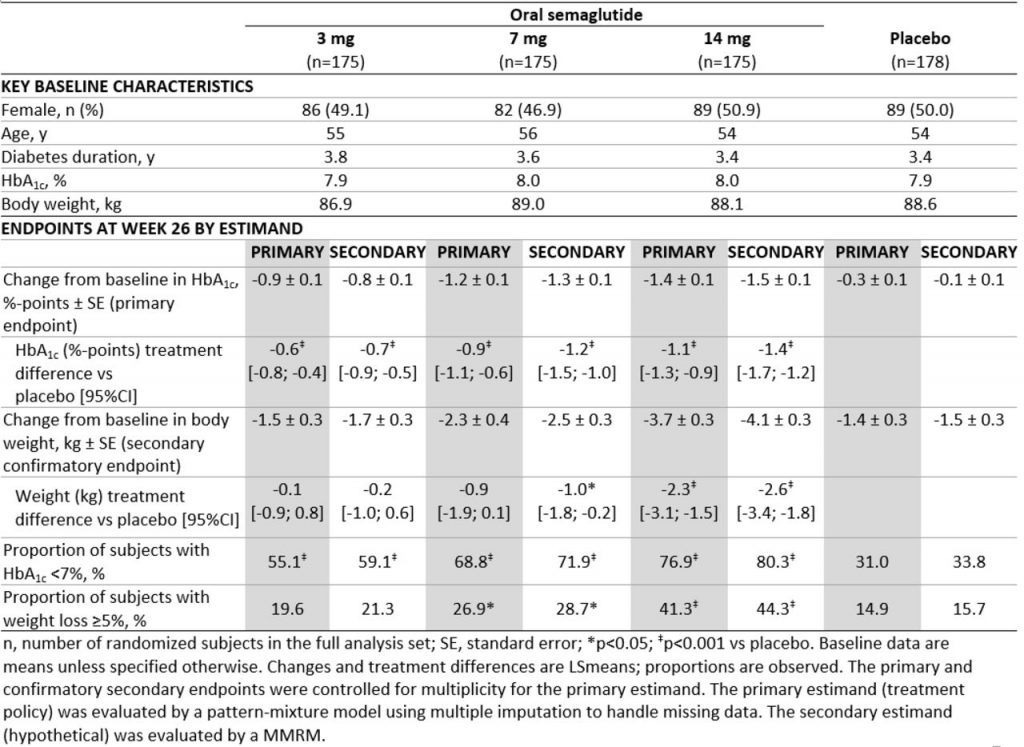
PIONEER1試験では、経口セマグルチドの3用量(3mg、7mg、14mg)すべてでHbA1cがプラセボに比べて有意に改善し、主要目的を達成した。26週にわたって700人あまりの2型糖尿病患者を対象に行われたこの試験では、経口セマグルチドが安全かつ忍容性も良好であることが示された。PIONEER1試験では、経口セマグルチドを服用した患者のHbA1cは、3mg群で0.8%、7mg群で1.3%、14mg群で1.5%低下した。プラセボ群は0.1%の低下で、ベースラインの平均HbA1cは8.0%だった。さらに、14mg群ではプラセボに比べて有意に大きく体重を減少させた。体重減少は3mg群と7mg群でも認められたが、統計学的な有意差はなかった。
Effect and Safety of Oral Semaglutide Monotherapy in Type 2 Diabetes—PIONEER 1 Trial
Diabetes 2018 Jul; 67(Supplement 1):
初めての経口GLP-1受容体作動薬である経口セマグルチドは、2型糖尿病の治療のための後期段階の開発段階にある。
食事療法・運動だけで薬物療法を受けておらず、血糖コントロールが不十分な2型糖尿病患者(n=703)を対象とした無作為化二重盲検プラセボ対照第3a相試験で、経口セマグルチドの効果と安全性(1日1回3、7、14mg)が評価された。
主要評価項目は、26週目のHbA1cのベースラインからの変化であった。
一次推定値(治療方針)は、治験薬の中止または救急薬の使用(有効性)にかかわらず、効果を評価した。二次推定(仮説)は、反復測定のための混合モデル(MMRM)を使用して救急薬なしで治療中(有効性)に試験製品の効果を評価したもので、以前の多くのT2D研究で使用された方法である。
26週目には、経口セマグルチドによりHbA1c(全用量)と体重(高用量)の両方が臨床的に意味のある減少を示した。有害事象は、それぞれ3、7および14mgの経口セマグルチドについて58,53および57%、プラセボで56%で発生した。最も一般的な有害事象は、一過性の軽度または中等度の悪心であった。悪心は、経口セマグルチド群患者の5〜16%に対しプラセボの患者で6%で発生した。経口セマグルチドは、HbA1c(全用量レベル)および体重(14 mg)の減少においてプラセボと比較して優位性を示し、食事療法および運動療法でコントロール不十分な2型糖尿病で高い忍容性を示した(ClinicalTrials.gov NCT02906930)。